
Pat.219802 Zastosowanie kompozycji 3-bromopirogronianu do wytwarzania leku do zapobiegania i leczenia kryptokokozy
Twórcy: Mariusz Dyląg, Paweł Lis, Young H. Ko, Peter L. Pedersen, Andre Goffeau, Stanisław Ułaszewski
3-bromopirogronian (3BP) jako analog kluczowego metabolitu komórkowego może stanowić alternatywne rozwiązanie tak w terapii nowotworów, jak też kryptokokozy. Pierwsze prace nad tym związkiem zostały wszczęte na Uniwersytecie Johns`a Hopkins`a w Baltimore (MA, USA) przez profesora P.L. Pedersen`a i dr YH. Ko, którzy byli pomysłodawcami i pionierami w badaniach nad 3BP. Dalsze badania na poziomie molekularnym prowadzone w ścisłej współpracy z profesorem S. Ułaszewskim z Uniwersytetu Wrocławskiego i jego zespołem, włączając dr M. Dyląga i dr P. Lisa, pozwoliły wykazać, że związek ten szczególnie łatwo wnika do wnętrza komórek nowotworowych, jak też komórek patogennych grzybów z rodzaju Cryptococcus. Wynika to głównie z obecności w błonie komórkowej swoistych białek transportujących kwasy karboksylowe i ich pochodne, dzięki którym związek ten osiąga wewnątrz komórek wysokie i terapeutycznie skuteczne stężenia. Związek ten już w stężeniach znacznie niższych od tych, w których powoduje całkowite zahamowanie wzrostu i proliferacji komórek doprowadza do drastycznego spadku wewnątrzkomórkowego stężenia ATP i w konsekwencji skutecznie zaburza gospodarkę energetyczną komórki.
3-BROMOPIROGRONIAN W LECZENIU KRYPTOKOKOZY
Zgodnie z zamieszczonymi przez WHO danymi statystycznymi tylko w roku 2020 zdiagnozowano 19 292 789 przypadków nowotworów, z czego niespełna 10 milionów ze skutkiem śmiertelnym. Z kolei na kryptokokozę, znajdującą się od 2013 roku w obszarze naszych zainteresowań, rocznie zapada około 1 miliona pacjentów, wśród których każdego roku stwierdza się 600 tysięcy przypadków śmiertelnych. Wiele obecnie dostępnych leków jest nieskutecznych w eradykacji tak jednej, jak i drugiej jednostki chorobowej, czy też jest obarczonych istotną toksycznością. Z tego względu naglącym problemem staje się znalezienie nowych rozwiązań zarówno w terapii nowotworów, jak też kryptokokozy.
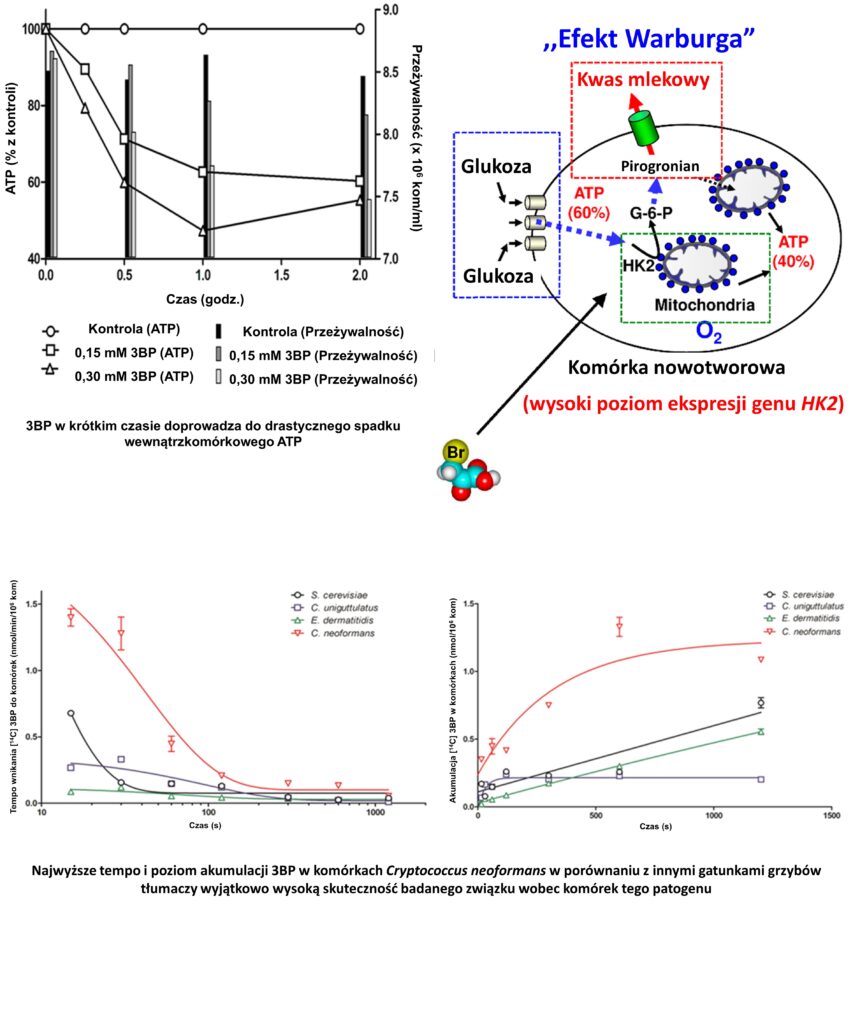
Jak wykazaliśmy w ramach naszych badań jego zróżnicowana aktywność wobec komórek różnych gatunków grzybów, jak też zdrowych i nowotworowych komórek ssaczych wynika z różnic na poziomie wewnątrzkomórkowej akumulacji i tempa wnikania tego związku do komórki. Wykazany w badaniach na ssaczych liniach komórkowych brak cytotoksycznego i mutagennego działania związku stały się podstawą do zaproponowania kompozycji farmaceutycznych tego związku skutecznych in vitro w eradykacji nowotworów (patent nr.: US 10,500,175 B2) oraz kryptokokozy.
